As pilhas podem ser consideradas "máquinas" que tem como funcionalidade serem um reservatório esgotável de energia, ou seja, funcionam como um gerador de energia, usando reações químicas para produzirem trabalho.
O desenvolvimento das pilhas ajudaram em muito à evolução da eletroquímica e da elétrica num geral, pois antes do desenvolvimento das mesmas, não haviam métodos para se produzir energia elétrica de forma química, ou seja, não se conheciam reações químicas que geravam eletricidade.
Na realidade as reações químicas não produzem energia elétrica, pois a mesma acaba por ser um subproduto da reação.
As reações que acabam produzindo energia elétrica, são as chamadas reações de oxi-redução, onde um composto ou elemento químico oxida e um outro reduz. Geralmente nas pilhas, esses compostos que reduzem e oxidam, são metais, pois existem muitos que são bastante reativos e outros que são pouco reativos.
Como regra básica, os metais pouco reativos dificilmente irão oxidar (perder elétrons) portanto agem como agentes oxidantes (os que promovem a oxidação de outros metais), enquanto os metais que são mais reativos oxidam facilmente, perdendo elétrons para os agentes oxidantes, agindo como agentes redutores, pois doam elétrons, que são partículas consideradas negativas. Como os compostos se encontram em estado neutro, aqueles que recebem os elétrons ficam com cargas negativas a mais, por isso se diz que aquele que recebe os elétrons é um redutor, pois reduz sua carga. Em contrapartida, quem doa os elétrons perde uma carga negativa, e por isso fica mais positivo.
Essa movimentação de elétrons gera a corrente elétrica, ou seja, para haver eletricidade, existe como requisito básico a movimentação de elétrons no sistema.
Como contextualização histórica e por critério de curiosidade, máquinas que geravam eletricidade, proveniente de dínamos, começaram a surgir por volta do século XVII com Otto Von Guericke, porém os principais estudos que levaram ao desenvolvimento da pilha começaram quando percebeu-se que os músculos das pernas de rãs sofriam espasmos quando tocava-se os tendões com um bisturi durante uma dissecação. Com isso acreditou-se por um tempo que os músculos armazenava energia elétrica. Porém Alessandro Volta percebeu que na realidade, os músculos sofriam espasmos não pelo fato de descarregarem energia elétrica com o toque de um metal, mas sim, que dois metais diferentes quando entram em contato em uma atmosfera úmida, gera um fluxo de elétrons, portanto corrente elétrica.
Com o desenvolvimento da técnica frente a essa descoberta, foram sendo descobertas várias configurações de montagem de pilhas, mas uma que se mostrou muito eficiente, foram as Pilhas Galvânicas (Células Galvânicas). Essas pilhas eram feitas com duas células separadas contendo uma solução de um sal do metal que sofrerá a redução ou oxidação. Esses metais ganham o nome de Eletrodos.
Essas pilhas inicialmente eram feitas com um único recipiente de vidro, onde os eletrodos podiam ficar imersos em uma solução de um sal, porem a corrente elétrica nem sempre se dava. Esse fato era causado por um efeito conhecido Potencial de Junção Líquida.
O Potencial de Junção Líquida nada mais é que a movimentação dos íons na solução. Um dos íons pode se mover de forma mais rápida que o outro e dessa forma acabar formando um potencial muito alto, o que acaba por impedir a movimentação dos elétrons no sistema, prejudicando a constância da corrente.
Esse problema foi resolvido com a separação dos eletrodos em dois recipientes de vidro, contendo uma solução de um sal do seu tipo. Portanto se um eletrodos era de Ag, a solução onde o metal ficaria imerso seria de um sal de Ag, como por exemplo o AgNO3.
Outro fato que melhorou muito a pilha, foi a introdução de um dispositivo que mantinha uma ligação entre as soluções, de forma que as mesmas não fiquem misturadas porém ligadas, mantendo a neutralidade do meio. Esse dispositivo é a Ponte Salina, um tubo de vidro em "U" contendo uma solução de um sal que tenha uma movimentação parecida dos seus íons (Como o KCl ou o KNO3). Essa ponte pode ser produzida preenchendo o tubo com a solução e fechando as pontas com algodão, ou com uma solução de Agar-Agar (uma gelatina) com o sal. Hoje em dia se usa muito a solução com Agar-Agar, pois a ponte fica muito mais fixa e estável (Sem criar bolhas, diluir-se ou alterar a concentração da solução). A Ponte Salina é tão indispensável que ela acaba por anular o Potencial de Junção Líquida, sendo que sem ela, a pilha não funciona, pois o circuito não se fecha.
Outro tipo de pilha é a Pilha de Concentração (Célula de Concentração), onde o esquema da pilha é igual ao mencionado anteriormente, porém nesse caso, ao contrário de haver dois eletrodos diferentes e soluções diferentes, usa-se eletrodos e soluções iguais, porém as soluções possuem concentrações diferentes. As soluções mais concentradas irão depositar íons sobre o eletrodo com finalidade de chegar a concentrações iguais de íons no meio com menos concentração. Ao mesmo tempo, parte dos elétrons no eletrodo da célula menos concentrada começam a ser removidos e os cátions formados são depositados no meio. Quando as concentrações tornam-se iguais, não existe mais reação se processando e com isso não se tem mais corrente de elétrons.
Os cátodos sempre serão os eletrodos que receberão os elétrons (agente redutor), o que causa um deposito dos íons metálicos da solução em sua superfície. O ânodo ocorre o contrário, sendo que o mesmo começa a ser corroído, e seus íons vão para a solução. Soluções que possuem cor devido a um cátion, começam a ficar mais claras com o decorrer da reação no cátodo e mais escura na célula onde se encontra o ânodo.
Por convenção nos esquemas desenhados ou montagem laboratorial, os cátodos sempre são positivos e se encontram do lado esquerdo nos esquemas (primeira célula) e os ânodos sempre negativos e se encontram no lado direito (segunda célula). Uma forma de se representar uma pilha de forma escrita é a seguinte (No caso Pilha Zinco-Cobre):
Zn°/Zn2+ || Cu2+/Cu°
Onde:
||: é a Ponte Salina.
Zn°/Zn2+: Metal neutro que perde elétrons (oxida) e torna-se um íon positivo.
Cu2+/Cu°: Íon positivo que recebe elétrons (reduz) e torna-se neutro.
Existe necessidade de conhecer as semi-reações de cada metal para pode ser desenvolver a parte teórica das pilhas. Para isso existem tabelas onde podemos coletar dados sobre a reatividade de metais e o potencial da reação.
Para calcular o Potencial da pilha, dentre outras coisas, como Força Eletromotriz e Energia Livre de Gibbs, usa-se a Equação de Nernst (Não demonstrarei a modelagem da equação).
Equação de Nernst:
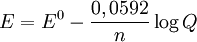
- Onde:
- E = Energia Potencial da Célula
- Eº = Energia Potencial Padrão
- n = Número de Elétrons envolvidos na reação
- Q = Quociente da Reação
- 0,0592 = (RT)/F, R = Constante dos Gases, T = Temperatura e F = Constante de Faraday
Logo abaixo temos algumas fotos de um experimento feito em um laboratório de ensino em físico-química na UFSCar (Universidade Federal de São Carlos).
 |
| Como há necessidade de aquecimento para o Agar-Agar se dissolver na água (como uma gelatina), os tubos em "U" devem ser levados a resfriamento. |



Nenhum comentário:
Postar um comentário